南京中醫藥大學醫學院韓欣教授團隊聯合南京郵電大學陸峰教授在ACS Nano (中科院一區,IF:15.8) 期刊上發表題為“Triggered Cascade-Activation Nanoplatform through Synergy for Effective Tumor Immunotherapy Guided by NIR-II Imaging” 的最新研究成果。
乏氧是實體腫瘤微環境的一大特征,乏氧與腫瘤的異常增殖、侵襲和轉移、治療抵抗高度相關,主要表現為藥物滲透障礙和腫瘤免疫抑制等。如何有效緩解腫瘤乏氧抑制腫瘤發生發展是一個重要挑戰。韓欣教授團隊近年來開發了多種基于納米載體的時空特異性調控的基因編輯體內給藥系統,實現了近紅外光精準調控基因編輯(Small, 2021;Biomaterials, 2021;Acta Pharm. Sin. B., 2023)、腫瘤微環境響應的基因編輯(Angew. Chem. Int. Ed., 2021;Acta Pharm. Sin. B. 2022;Small, 2022;Chem. Eng. J., 2024)、生物正交反應介導的基因編輯(Angew. Chem. Int. Ed., 2023),在此基礎之上,該團隊利用乏氧響應的基因編輯技術敲低HIF-1α并協同乏氧激活的前藥替拉帕扎明(TPZ),重塑腫瘤免疫微環境,同時該納米藥物還具備NIR-II近紅外二區成像能力,實現腫瘤診療一體化。該納米藥物具有腫瘤微環境逐級響應釋放核殼結構,大大提高了基因編輯大分子藥物與化療小分子藥物體內共遞送的級聯釋放能力和生物安全性。
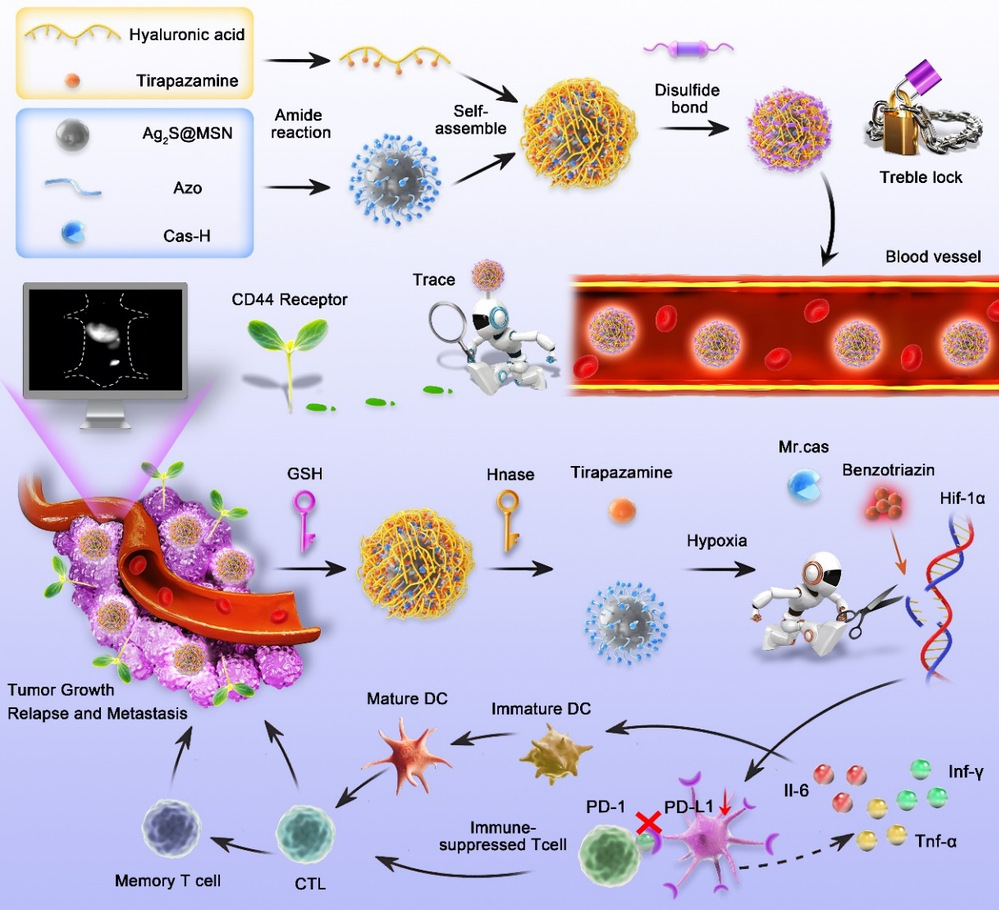
該研究開發了一種“三鎖”多功能納米藥物載體(AA@Cas-H@HTS),依次響應腫瘤微環境中的谷胱甘肽(GSH)、透明質酸酶(HAase)和乏氧信號(Hypoxia),從而實現基因編輯大分子藥物與化療小分子前藥的精準可控激活。首先合成的AA@Cas-H@HTS具有核殼結構,二氧化硅涂層的硫化銀量子點(Ag2S@SiO2)作為載體通過偶氮鍵連接CRISPR-Cas9 RNP系統,形成第一層防御外殼(AA@Cas-H);其次,利用疏水前藥TPZ和親水透明質酸(HA)偶聯制備TPZ修飾的透明質酸聚合物(HT),通過自組裝作用將基因編輯大分子藥物封裝在HT中,形成第二層防御外殼(AA@Cas-H@HT);最后,利用二硫化物進一步交聯HT形成第三層防御外殼(AA@Cas-H@HTS)。實驗結果表明,HTS納米藥物載體具備良好的長血液循環能力、特異的腫瘤靶向能力以及優良的NIR-II近紅外二區成像能力。通過CRISPR-Cas9介導的HIF-1α敲低和乏氧激活前藥TPZ協同作用,有效抑制PD-1/PD-L1通路改善腫瘤免疫抑制性微環境,為實現個性化的腫瘤精準治療和診療一體化提供了新的技術方法和策略。
韓欣教授課題組醫學院青年教師紀鈺和博士研究生曲蘇晨(現為中藥制藥過程控制與智能制造技術全國重點實驗室固定成員)為該論文共同第一作者,韓欣教授為該論文的責任通訊作者,南京中醫藥大學為第一通訊單位。該研究工作得到了國家自然科學基金項目(21975131)、江蘇省自然科學基金項目(BK20210685)、江蘇高校優勢學科建設工程資助項目(中西醫結合)、江蘇省重點學科(生物學)、長三角科技創新共同體聯合攻關計劃項目(2023CSJZN0600)等項目資助。
原文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.4c11334







 版權所有? 2024南京中醫藥大學 網站備案號:蘇ICP備15021406號-1 公安備案號:蘇公網安備32010602010028號
版權所有? 2024南京中醫藥大學 網站備案號:蘇ICP備15021406號-1 公安備案號:蘇公網安備32010602010028號